Применение первого начала термодинамики к изопроцессам
Первое начало термодинамики для адиабатического процесса имеет вид: , то есть газ совершает работу за счет изменения внутренней энергии. Расширение газа в пустоту — пример необратимого процесса. Зависимость химического потенциала. Для описанного случая подходит взаимосвязь учитывающая внутреннюю энергию газообразного вещества:.
Сначала газом заполнен первый из сосудов, одновременно второй наполнен вакуумом. При открытии соединительного вентиля начинается расширение газа. Он заполнит обе емкости, и установит новое равновесие. Внутренняя энергия идеального газа меняется лишь из-за нагрева или охлаждения, поэтому температура газа в начале и в конце будет одинаковой. Изображение этих состояний как точек на графике p-V показывает, что они находятся на единой изотерме. Все переходные положения не могут быть равновесными и нет возможности показать их на диаграммах.
Когда наблюдается расширение газа в вакууме, происходит необратимый процесс. Его не удастся провести в обратном направлении. Главная Справочник Первый закон термодинамики. Поможем решить контрольную, написать реферат, курсовую и диплом от р Узнать стоимость. Первый закон термодинамики Поможем сделать домашку Online Первое занятие бесплатно.
Решение задачи по физике Выполнение дня. Заказать Подробнее. Контрольные по физике Выполнение 1—4 дня. Лабораторные по физике Выполнение 1—3 дня. Содержание: Первое начало термодинамики, определение Термодинамика для газообразных веществ Для изучения движения энергии, выделяемой как определённым термодинамическим комплексом элементов, так и внешними объектами используется ряд универсальных правил.
Первое начало термодинамики, определение На термодинамику распространяется действие закона преобразования и сохранения энергии.
Определение 2 Теплота, приобретаемая структурой, идёт на увеличение внутренней энергии, а также на выполнение работы над объектами внешней среды. Определение 6 Адиабатическая оболочка — это емкость, стенки которой непроницаемы для тепла. Определение 7 Расширение или сжатие газообразного вещества, происходящее в адиабатических оболочках называют адиабатическими процессами.
Определение 9 Расширение, а также сжатие на графике функций p-V иллюстрируется криволинейной линией, с названием адиабата. Пример 1 Примером изменения неквазистатического характера, где переходные положения не бывают в равновесии, является расширение газа, помещённого в вакуум.
Мы помогли уже 4 ученикам и студентам сдать работы от решения задач до дипломных на отлично!
Узнай стоимость своей работы за 15 минут! Узнать стоимость. Пример 2 Когда наблюдается расширение газа в вакууме, происходит необратимый процесс. Первый закон термодинамики закон сохранения энергии для тепловых процессов определяет количественное соотношение между изменением внутренней энергии системы U, количеством теплоты Q, подведенным к ней, и суммарной работой внешних сил A , действующих на систему. Первый закон термодинамики выглядит так: Газ увеличивает свою внутреннюю энергию за счет теплоты, полученной из внешней среды.
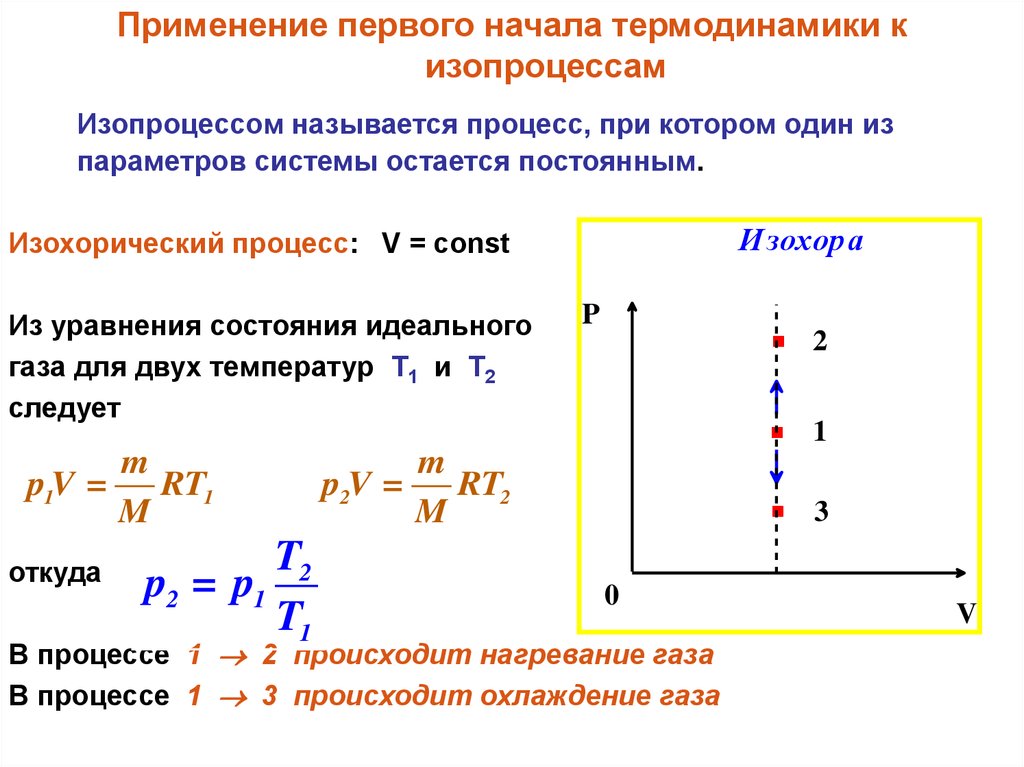
При изохорном процессе объем газа остается постоянным, поэтому газ не совершает работу. Изменение внутренней энергии газа происходит благодаря теплообмену с окружающими телами: Б изохорное охлаждение. При изохорном охлаждении T 2.
Изотермический процесс. Изобарный процесс. Первый закон термодинамики выглядит так: Газ получает тепло из внешней среды. Полученная таким образом энергия тратится на увеличение внешней энергии и на совершение работы. Б изобарное охлаждение При изобарном охлаждении температура уменьшается T 4. Адиабатный процесс. Адиабатный процесс - термодинамический процесс в теплоизолированной системе.
Теплоизолированная система - система, не обменивающаяся энергией с окружающими телами. А адиабатное сжатие. Первый закон термодинамики выглядит так: Над газом совершается работа, при этом внутренняя энергия газа увеличивается. Б адиабатное расширение. При адиабатном расширении температура уменьшается T Решение задач.
A 2 Если идеальный газ отдал количество теплоты Дж и при этом внутренняя энергия газа уменьшилась на Дж, то работа, совершённая газом, равна: 1 — Дж; 2 Дж; 3 Дж; 4 0 Дж. A 3 На рисунке изображён процесс перехода некоторого количества идеального газа из состояния 1 в состояние 2. Какое из перечисленных ниже утверждений справедливо для этого процесса? В1 У становите соответствие между физическими величинами, характеризующими процесс изотермического сжатия воздуха, перечисленными в первом столбце, и их изменениями, указанными во втором столбце.
Б Температура. В Внутренняя энергия. Запишите в таблицу выбранные цифры для каждой физической величины. Цифры могут повторяться. B 2 Установите соответствие между физическими величинами, характеризующими изохорный процесс охлаждения воздуха, перечисленными в первом столбце, и их изменениями, указанными во втором столбце.
Его математическая формулировка. Стимулы самопроизвольного изменения термодинамической системы. Энтропии как мера энергетического беспорядка, ее статистическая природа и связь с теплотой обратимого процесса. Исследование процессов с помощью уравнение состояния идеального газа.
Связь между давлением, объемом и температурой и вывод уравнения Менделеева - Клайперона. Изотермический процесс. Характеристика и уравнения графиков изопроцессов состояния газов. Понятия равновесного состояния и обратимого процесса в термодинамике. Коэффициент полезного действия цикла Карно для идеального газа.
Формулы подсчёта изменения энтропии в случае изопроцессов для идеального газа. Энтропия и второе начало термодинамики. Термодинамические процессы идеальных газов в закрытых системах.
Параметры состояния термодинамической системы. Формулировка первого, второго законов термодинамики. Термические параметры состояния: плотность, давление и температура.

Уравнение состояния идеального газа. Теплота и работа. Понятие удельной, молярной и объёмной теплоёмкости.

Принцип существования энтропии. Работы в архивах красиво оформлены согласно требованиям ВУЗов и содержат рисунки, диаграммы, формулы и т. Рекомендуем скачать работу и оценить ее, кликнув по соответствующей звездочке. Главная База знаний "Allbest" Физика и энергетика Применение начала термодинамики к изопроцессам - подобные работы. Внутренняя энергия как величина, характеризующая собственное состояние тела.
Формулировка первого начала термодинамики: для тепловых процессов, для идеального одноатомного газа. Его применение для изохорного, изотермического, адиабатного процессов. Основы термодинамики. Законы термодинамики и термодинамические параметры систем. Категории и законы термодинамики и электростатики. Развитие термодинамики. Второй закон термодинамики и его приложения. Фундаментальные уравнения термодинамики.
Основные элементы термодинамики. Основные положения технической термодинамики. Основные понятия и постулаты термодинамики. Предмет теплотехники. Основные понятия и определения. Третье начало термодинамики. Три начала термодинамики. Основы термодинамики, закон Больцмана. Устройство, нарушающее второе начало термодинамики.
Понятие термохимии. Молекулярная физика и термодинамика. Второе начало термодинамики. Применение уравнения состояния идеального газа к изопроцессам. Основные понятия и определения теплотехники. Законы термодинамики. Страница: 1 2 3 4 5.